گردآوری : آقایان مهندس داود زحمتکش، مهندس حامد حسین زاده،مهندس اسماعیل دودمان
تاریخ :6 اردیبهشت 1403
شرکت: پتروشیمی بوشهر
میانگین زمان خواندن:45دقیقه
چکیده:
هیدروژناسیون کاتالیزوری CO2 در راستای کاهش مقدار فشار و دمای عملیاتی به واسطهی بهبود کیفیت انتخابپذیری و ارتقای بازده فرآیندتولید متانول، دارای پتانسیل بالایی میباشد. تحقق این امر با به کارگیری نسبتهای خاص در فرآوری کاتالیست و نیز استفاده از مقادیر تنظیم شدهی عناصر مناسب در آن، میسر میباشد. لذا مطالعه و بررسی روشهای توسعه کاتالیستهای نوین و بسیار کارآمد برای هیدروژناسیون کاتالیستی CO2 به منظور تولید آسانتر متانول، به کمک گازهای سنتز، از اهمیت ویژه ای برخوردار است. پژوهشهای اخیراً، عمدتاً بر توسعه کاتالیزورهای پربازده، انتخابپذیر و پایدار به منظور تولید متانول متمرکز شده است. این بررسی نیز، پیشرفتهای فعلی را در تبدیل کاتالیستی CO2 توسط H2 برای سنتز متانول، از جنبههای عملکرد، انتخابپذیری و پایداری کاتالیزور بیان میدارد و روشهای تجربی مورد استفاده برای سه مسیر اصلی برای هیدروژناسیون کاتالیزوری CO2 با استفاده از کاتالیزورهای مختلف مورد بحث قرار میدهد( یعنی تبدیلCO به CO2 از طریق واکنش جابجایی گاز-آب برگشتپذیر، CO2 به سنتز متانول، و CO2 به دیگر هیدروکربنها از طریق واکنش فیشر-تروپش). کاتالیستهای مختلف در شرایط دمایی و فشاری و نیز با درصد ترکیبات متفاوت مورد ارزیابی قرار گرفت؛ به نظر میرسد کاتالیستهایی که دارای ترکیبات اندکی از زیرکونیوم(Zr)، روی (Zn) و سریوم(Ce) در ساختار پایه آن باشد، دارای پایداری، انتخاب پذیری و بازده اقناع کنندهتری نسبت به سایر آنها میباشد.
کلیدواژه: متانول، انتخابپذیری، پایداری،کاتالیست، سینتیک
1- مقدمه
تقاضای جهانی متانول بسیار زیاد و حدود 85 میلیون تن در سال میباشد. و لذا فرایند تولید متانول از نظر مقیاس تولید در رتبه دوم جهانی است. این سیستم کاتالیستی به عنوان تولید کننده یک سوخت ترکیبی پایدار و قابل قبول که از هیدروژنه کردن CO2 حاصل از طبیعت یا از طریق سوزاندن متان ایجاد میگردد، بسیار مورد توجه واقع شده است [1].
یکی از دغدغههای اساسی در صنعت تولید متانول، عدم وجود کاتالیستهاییست که در فشار و دمای نسبتا کم، عملیات سنتز متانول را نتیجه دهد؛ که قاعدتا بخش عمدهی هزینه اولیه (و جاری) گزافی که در دایر کردن مجتمعهای تولیدی متانول مصروف میشود، ریشه در همین مسئله دارد. دلیل آن نیز لزوم تعویض کاتالسیت در بازههای زمانی کوتاه و همچنین به کارگیری کمپرسورها، پمپها، لاینها، سازهها و سایر تجهیزات فرآیندی فشار بالا ،که خود موجب استهلاک سریعتر مجتمع میگردد، میباشد. بنابراین پر واضح است انجام مطالعات میدانی برای ساخت و بررسی عملکرد کاتالیستهای توسعه یافتهای که در جهت مرتفع کردن این معضلات، تاثیر شایان توجهی داشته باشد، اهمیت بالایی داشته و این گردآوری نیز درصدد یافتن پاسخی درخور در این راستا میباشد.
مخلوط اکسیدهای سه جزئی مس، روی و آلومینیم بهعنوان کاتالیست مرسوم این فرآیند در صنایع فعلی مورد استفاده قرار میگیرد. در اغلب موارد فرآیند تولید کاتالیست بطور کلی شامل هم رسوبی محلول نیتراتهای فلزی با سدیم کربنات یا آمونیوم کربنات است که بعد از مراحل شستشو، تکلیس[1] و احياء، فاز فعال CuZnO/Al2O3 تشکیل میگردد. معمولا تولید کاتالیست در مقیاس انبوه از طریق فرآیند هم رسوبی ناپیوسته انجام میشود که از مزایای این روش میتوان به دسترسپذیری و آسان بودن کنترل فرآیند آن اشاره نمود. بعد از رسوب گیری، عملیات پیرسازی انجام میشود. در طی پیرسازی چندین فرآیند اتفاق میافتد که به طور موثر میتواند خصوصیات ماده نهایی را تغییر دهد.
از منظر صرفه اقتصادی، اغلب کاتالیستهای صنعتی، کاتالیستی میباشد که در اغلب آنها درصد مولی مس (بر اساس مس فلزی)، بیشتر از ۵۰% و داری نانو ذرات (NPs) مس تقریبا کروی با اندازه حدود ۱۰ نانومتر، و همچنین دارای نانوذرات روی اکسید است که این دو نوع نانو ذره به شکل تناوبی مرتب شده اند تا دانه های متخلخلی را ایجاد کنند. این دانه ها سطح مس زیادی تا حدود 1-m2g 40 در دسترس قرار می دهند. علاوه بر این، کاتالیزور صنعتی حاوی مقدار کمی اکسید مقاوم به گرما (در اغلب موارد تا مقدار %۱۰ از Al2O3) به عنوان ارتقاء دهنده ساختاری است [2]. حذف هر یک از عناصر تشکیل دهنده عملکرد سیستم را به شدت کاهش می دهد.
یک نکته مهم و کلیدی برای نشان دادن عملکرد بالای کاتالیستی در دسترس بودن مساحت قابل توجهی از سطح مس میباشد. از بررسی مطالعات صورت گرفته مشاهده شده است، فعالیت برای نمونههای با روش استحصال مشابه، به صورت خطی با سطح مس تغییر میکند[3] با این حال، بین خانواده کاتالیستهای ساخته شده با روشهای متفاوت، فعالیت ذاتی متفاوتی میتوان یافت، بنابراین، عملا “کیفیت” های مختلفی از سطح مس را میتوان تهیه کرد که در فعاليت موضعهای فعال و یا در غلظت این موضع [2]ها تفاوت دارند. از این رو، به نظر میرسد واکنش سنتز متانول روی کاتالیست مس یک واکنش حساس-به-ساختار میباشد. به عبارت دیگر نوع سطح مس نیز فعالیت کاتالیست را تغییر می دهد نه صرفا اندازه آن[4-6].
2- کاتالیستهای سنتز متانول
اولین کاتالیستهای صنعتی متانول شامل ZnO/Cr2O3 در دما و فشار بالا عمل میکردند و نسبت به گوگرد و کلر موجود در گاز سنتز بسیار مقاوم بودند. متانول سنتز شده به این روش به دلیل فشار بالای سیستم (۲۵ تا MPa ۳۵) چندان اقتصادی نبود و به همین دلیل این فن آوریها با سنتز در فشار کم جایگزین شد. کاتالیستهای مصرفی در فرآیند فشار پایین شامل مس بوده و در دمای C° 300 و فشار MPa 10-5 عمل میکند. عمدتا کاتالیست های شامل Cu/Zn/Al از روش همرسوبی محلول نمکهای نیترات با هیدروکسی یا کربناتهای بازی بدست میآیند [7, 8]. پیش ماده حاصل (عمدتا هیدروکسی کربنات فلزها) از محلول مادر به کمک عملیات صاف کردن چند باره برای حذف یون های مزاحم (نظير Na) شسته شده و در نهایت در C° 120-100 خشک می گردد. پیش ماده مزبور در اثر تکلیس در 300 تا C° 500 به اکسیدهای فلزی ( CuO/ZnO/Al2O3) تبدیل می شود. سپس ترکیب کلسینه شده بصورت دانه ای (Pellet) در آمده که این دانه های استوانهای 4 تا mm 6 قطر و تقریبا همین مقدار ارتفاع دارند [9]. به طور کلی میتوان گفت که آلومینا به عنوان ارتقاءدهنده ساختاری برای رسیدن به فعالیت و پایداری بالا در کاتالیست شناخته شده است.
مشاهده میشود دو عامل مهم در طول عمر کاتالیست مؤثر است: الف) کلوخه شدن بلورهای مس و ب) مسموم شدن کاتالیست در دمای واکنش (C 200-300). اگر ذرات مس در فاصله نزدیکی از یکدیگر باشند؛ روی اکسید از طریق تشکیل پیوند الکترونی با بلورهای مس موجب جدا شدن این ذرات از هم شده و در نتیجه کلوخه شدن ذرات صورت نمی گیرد. همچنین عامل مسموم کنندهی مهم کاتالیست سنتز متانول، سولفور می باشد؛ از این رو، اکسید روی در حذف H2S ناشی از بخارات گاز از طریق تشکيل سولفید روی مؤثر میباشد.
3- سینتیک سنتز متانول
تا سال ۱۹۸۲ میلادی اکثر رابطههای سینتیکی برای واکنش سنتز متانول چه برای کاتالیست روی پایه ی مسی و چه برای کاتالیست :ZnO/Cr2O3 ، حتی موقعی که در خوراک CO وجود دارد، تنها دارای جملات فشارهای جزیی H2 و CO بود. البته یک استثناء در این مورد معادلهی Bakemeier و همکاران [10] برای کاتالیست ZnO/Cr2O3 است که دارای جمله ی مربوط به CO2 نیز می باشد. این رابطه پیش بینی می کند که اضافه شدن CO به مخلوط 2/H Co باعث کاهش سرعت واکنش می شود. در اکثر کارهای اولیه، برای جور کردن نتایج بدست آمده در یک عبارت شامل فشارهای جزیی CO و H2 فرض می شد که متانول طبق رابطهی (1) از CO تولید می شود تا طبق واکنش (2) از CO2. اما به هر حال لازم به ذکر است که بر طبق رابطه انتقال آب-گاز (3) که علاوه بر واکنش (1) و (2) در طی سنتز متانول روی می دهد فشارهای جزیی CO و CO2 با یکدیگر در ارتباط بوده و از یکدیگر قابل جداسازی نمیباشد.
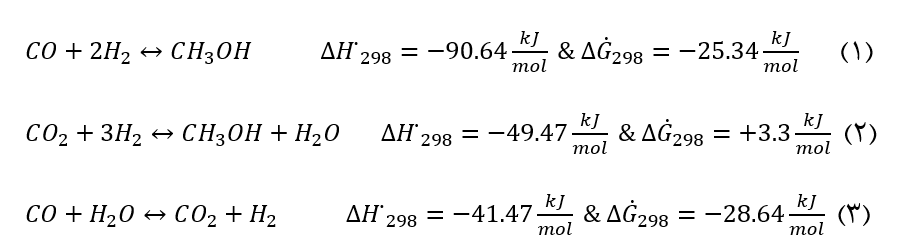
به طور کلی وقتی که معادلهی سرعت به صورت سری توانی از فشارهای جزئی H2 و CO نوشته می شود، معادله ای که سرعت سنتز متانول را نشان می دهد توسط رابطه (4) بیان می گردد:

که در آن ثابت تعادل واکنش (1) و p فشار جزیی و یا فوگاسیتهی مواد اولیه و یا محصولات می باشد. جمله ی منفی که دارای K می باشد مشخص می سازد که سرعت واکنش تحت تاثیر واکنش برگشت (تجزیه متانول) قرار می گیرد که وقتی به تعادل نزدیک می شویم سرعت این واکنش (واکنش تجزیهی متانول) افزایش یافته و تأثیر آن بیشتر می گردد. از آنجایی که فرآیندهای صنعتی حتیالامكان طوری طراحی می شود که به نزدیکی نقطهی تعادل برسد، لذا در مقیاس صنعتی بایستی تمامی ضرایب به حساب آیند. به طور تقریبی در این معادله مقدار n بین 25/0- 75/0 و مقدار m در محدوده ی 7/0 تا 2 می باشد. بنابراین سرعت سنتز متانول به فشار جزیی H2 بستگی بیشتری نسبت به فشار جزیی CO دارد. برخی از معادله ها با اضافه نمودن یک جمله ی اضافی علاوه بر واکنش تجزیه ی متانول، اثر بازدارندگی دیگری ناشی از تولید متانول نشان می دهند[10].
3-1- سینتیک واکنش سنتز متانول روی کاتالیست مس روی پایه
ماتولويكز[3] [11] همانند محققین پیشین با استفاده از نتایج به دست آمده از کاتالیست CuZnO/Al2O3 عبارت سینتیکی که دارای جملات فشارهای جزیی H2 و CO بود به دست آورد. آگنی[4] و تاکودیس[5] نیز یک عبارت سینتیکی برای کاتالیست CuZnO/Al20 ارایه کردند [12]. این محققین از یک راکتور دیفرانسیلی با حداکثر درجهی تبدیل 35/1 % استفاده نمودند؛ در صورتی که که اکثر محققین دیگر راکتور انتگرالی که در آن به علت داشتن تبدیل بالا افزایش دمای قابل توجهی ایجاد می شود را بکار برده اند. این دو محقق دریافتند که انرژی فعال سازی ظاهری با دما تغییر می کند یعنی مقدار آن از kJ 142.3 در دمای C° 250 به مقدار kJ 7/106 در دمای °290C می رسد.
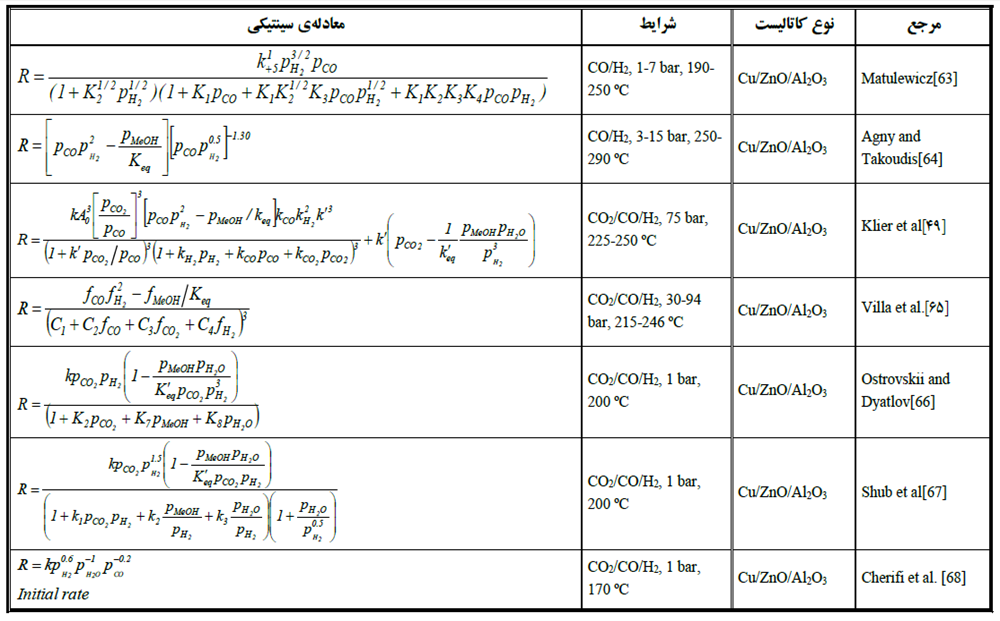
هرمن[6] و همکاران [13] و بگوئین و همکاران [14] غير فعال شدن غیر برگشت پذیری را در مورد کاتالیست Cu/ZnO در اثر خوراک H2/CO مشاهده نمودند. آنها این پدیده را به احیا بیش از حد گونههای مس موجود در شبکهی Cu/ZnO نسبت دادند.در جدول (1) معادلات سینتیکی ارائه شده توسط محقیقین مختلف برای سنتز متانول در حضور کاتالیست آورده شده است.
جدول (1): معادلات سینتیکی ارائه شده برای سنتز متانول روی کاتالیست مس
4- کاتالیستهای نوین سنتز متانول
در این بخش، تمرکز روی مطالعات انجام شده در زمینهی کاتالیستهای جدید به منظور سنتز متانول است و شرایط عملیاتی، سینتیکی و موارد مختلف در ساخت کاتالیست ها مورد بررسی قرار گرفته است.
وانگ و همکاران [15] یک کاتالیزور CuO-ZnO-ZrO2-MxOy با نام تجاری(CZZM) -که به جای M می تواند Mo و Cr و W قرار گیرد- با نسبت مولی 5-2-5/2-5/0 تهیه نمودند. آنها اثر هم افزایی بین ZrO2 و کاتالیزور مس، بر عملکرد کاتالیزوری در هیدروژنه کردن CO2 را مورد بررسی قرار دادند. محصولات اصلی مونوکسید کربن، متانول و آب بودند. پس از مقایسه CZZM با کاتالیزور CZZ از نظر تبدیل CO2، انتخاب پذیری متانول، و بازده، مشاهده کردند که افزودن MoO3 و WO3 عملکرد کاتالیزوری بهتری نسبت به CZZ از خود نشان می دهند، در حالی که برای Cr2O3 برعکس بود. CZZW بالاترین گزینش پذیری و بازده را برای تولید متانول نشان داد که 15 و 22 درصد بیشتر از آنچه برای کاتالیزور CZZ محاسبه شده بود، نشان داد. پیکهای XRD نشان داد که Mo و W اندازه بلورهای مس را کاهش میدهند، در حالی که کروم تبلور مس را ارتقا داده و اندازه بلور را افزایش میدهد. در نتیجه، مساحت سطح CZZMo و CZZW بزرگتر از CZZ بود، در حالی که مساحت سطح CZZCr کاهش یافته بود. نه تنها دادههای XRD، بلکه نتایج H2-TPR و XPS نیز نشان میدهند که W و Mo خواص کاتالیزوری کاتالیزور Cu/ZnO را بهبود میبخشند. بنابراین، CZZW و CZZMo بازده و گزینش پذیری متانول را افزایش دادند.
1-4-تاثیر دما و روش ساخت بر کاتالیست:
در یک مطالعه، لی و همکاران[16] از کاتالیزور Cu/AlCeO استفاده کردند که سطح بالای BET و پایداری حرارتی Al2O3 و اساسی بودن CeO2 برای تهیه یک مجموعه کاتالیزور بسیار کارآمد را نشان داد. برای ارزیابی عملکرد کاتالیست Cu/AlCeO، عملکرد کاتالیزوری Cu/Al2O3، Cu/CeO2 و Cu/AlCeO مقایسه شد. آزمایش واکنش در محدوده دمایی 200-280 درجهی سانتیگراد و در 3 مگاپاسکال انجام شد. تبدیل CO2 به متانول برای کاتالیزورهای Cu/Al2O3، Cu/AlCeO و Cu/CeO2 به ترتیب 5/1، 9/2 و 2/1 درصد در دمای 200 درجه سانتیگراد و 9/19، 7/23، و 9/13 درصد در دمای 280 درجهی سانتیگراد بود. دمای واکنش نه تنها بر تبدیل CO2، بلکه بر گزینش پذیری نسبت به متانول نیز تأثیر میگذارد. گزینشپذیری در ◦C200 بالاترین مقدار را نشان داد و سپس با افزایش بیشتر دما، مقدار آن کاهش یافت. کاتالیزور Cu/AlCeO در دمای 200 درجه سانتیگراد 85 % و در دمای 280 درجه سانتیگراد گزینش 22 % از خود نشان داد. نتایج نشان داد کاتالیزور Cu/AlCeO یک اثر همافزایی بین Al2O3 و CeO2 نشان میدهد که به عنوان یک پشتیبانی برای کاتالیزور مبتنی بر Cu استفاده میگردد.
داسیردی و همکاران [17] یک سری کاتالیزور Cu/Zn/Al را با استفاده از روشهای مختلف برای یافتن بهترین روش آمادهسازی برای به دست آوردن کاتالیزورهای سطح بالا تهیه کرد. آنها از چهار روش استفاده کردند: رسوب همزمان، رسوب همزمان اولتراسونیک، احتراق سل-ژل و سنتز حالت جامد. کاتالیزورها در محدوده دمایی 200-400 ◦C در فشار 20 بار به مدت 5 ساعت بررسی شدند. در وضعیت خالی، هیچ تبدیل CO2 مشاهده نشد. همه روش ها از نظر خواص بافتی، تبدیل CO2 و گزینشپذیری متانول، مورد ارزیابی قرار گرفتند.
کاتالیزور تهیه شده با استفاده از رسوب همزمان اولتراسونیک دارای بالاترین سطح و احتراق سل-ژل کمترین سطح را داشت. هیچ یک از کاتالیزورها پیک آلومینا را نشان ندادند، که نشان می دهد Al در حالت بی شکل یا بی نظم است. اندازه بلور مس در محدوده 9 تا 16 نانومتر بدون توجه به نحوه تهیه کاتالیزور بود. در دماهای پایین تر، یعنی 200-250 درجه سانتیگراد، روش اولتراسونیک بالاترین تبدیل را داشت، در حالی که همه کاتالیزورها تبدیل CO2 مشابه (38%) را در دمای بالاتر نشان دادند، زیرا به نقطه تعادل ترمودینامیکی رسیدند. گزینشپذیری متانول خوب در دمای 200-250 ◦C با استفاده از روشهای رسوب همزمان و مافوق صوت به دست آمد.
نگوین و همکاران [18] یک کاتالیزور مبتنی بر Ni-Ga را برای حل گزینش پذیری کم و فشار بالای کاتالیزورهای Cu/ZnO/Al2O3 بررسی کردند. آنها انواع مختلفی از کاتالیزورها را تهیه کردند که نسبت مولی Ni/Ga (1:3، 3:3، 5:3، و 7:3) و روش تهیه کاتالیزور (هم تراکم- تبخیر و هم تراکم) را کنترل می کردند. گاز خوراک مخلوطی از 25 درصد CO2 و 75 درصد H2 بود. کاتالیست تهیه شده با استفاده از نسبت مولی Ni/Ga 5:3 گزینش پذیری 60 درصد را حفظ کرد و پس از 20 ساعت واکنش بیشترین پایداری را نشان داد. کاتالیزورهای دیگر در طول تبدیل CO2 به متانول پایداری مناسبی از خود نشان ندادند. دمای آماده سازی نیز بر عملکرد کاتالیزور تأثیر می گذارد. چندین کاتالیزور با استفاده از نسبت مولی Ni/Ga 5:3 در دماهای بین 50 تا 90 ◦C تهیه شد. کاتالیزور تهیه شده در دمای 80 درجه سانتیگراد بالاترین پایداری را از نظر گزینش پذیری متانول مشاهده شده با زمان نشان داد که در مقایسه با 9، 13، 16 و 17 ساعت برای کاتالیزورهای تهیه شده در دمای 5، 60، 70 و 90 درجه سانتیگراد، گزینش پذیری متانول را بیش از 60 درصد در 20 ساعت حفظ کرد. روش آماده سازی نیز بر ساختار کاتالیست تاثیر دارد. هنگام مقایسه روشهای هم تراکم-تبخیر و هم تراکم، روش دوم برای سنتز کاتالیزورهای Ni-Ga مناسب است. بنابراین، کاتالیزور Ni-Ga تهیه شده با استفاده از نسبت 5:3 Ni/Ga از طریق روش همتراکم- تبخیر برای تبدیل CO2 به متانول مناسبتر بود.
اوجلاد و همکاران [19] عملکرد کاتالیزوری یک کاتالیزور PdZn/CeO2 با 5 درصد وزنی کلسیم را گزارش کرد. نشان داده شد که حضور Pd مرحله تفکیک H2 را در دمای 550 درجه سانتیگراد تسریع میکند، که حداقل نیاز برای کاهش CeO2 به Ce2O3 است. سریم کاهش یافته نقش کلیدی در هیدروژنه شدن CO2 ایفا می کند. کاتالیزور با استفاده از 8 درصد وزنی Pd و 5 درصد وزنی روی (نسبت 1:1 M Pd/Zn) با استفاده از روش سل-ژل تهیه شد. کاتالیزور در محدوده دمایی 180-270 درجه سانتیگراد در فشار 20 بار با استفاده از نسبت 3:1 M H2/CO2 بر روی کاتالیزور PdZn/CeO2 مورد بررسی قرار گرفت. در دمای 180 درجه سانتیگراد، تبدیل CO2 حدود ~% 8 بود و متانول تنها محصول واکنش بود. با افزایش دمای واکنش به 270 درجه سانتیگراد، تبدیل CO2 افزایش یافت. با این حال، در دمای 250 درجه سانتیگراد، CO از طریق واکنش RWGS تولید شد که باعث کاهش بازده متانول شد. مشاهده شد که بازده فضای زمانی متانول تا 220 درجه سانتیگراد افزایش و پس از آن کاهش یافت. بنابراین، دمای 220 درجه سانتیگراد برای کاتالیزور PdZn/CeO2 برای سنتز متانول با 14% تبدیل CO2 و 95% انتخاب پذیری متانول مناسب بود. این نتیجه عملکرد برتر خود را در مقایسه با سایر کاتالیزورهای مبتنی بر Pd که برای سنتز متانول گزارش شده است نشان داد.
2-4-تاثیر PH و مورفولوژی ذرات بر بازدهی کاتالیست:
شیائو و همکاران [20] کاتالیستهایی از یونهای Cu-Zn-Al-Zr (Cu2+/Zn2+/Al3+/Zr4+ =2:1:1.2:0.1) در مقادیر PH 6 تا 11 سنتز کردند تا یک مجموعه کاتالیست Cu/ZnO/Al2O3/ZrO2 با استفاده از روش همرسوبی ساخته شده و اثر pH بر خواص کاتالیزوری آنها را مورد مطالعه قرار دادند. عملکرد کاتالیزور در دمای ◦C 190 و فشار 5 مگاپاسکال با استفاده از نسبت 3:1 H2/CO2 مورد بررسی قرار گرفت که متانول و CO تنها محصولات این واکنش بودند. در کاتالیزور تهیه شده در PH=6 به دلیل کاهش ناقص و حضور کاتیون های مس، درصد تبدیل CO2 بسیار کمتر از سایر کاتالیزورها بود. تبدیل CO2 و گزینش پذیری متانول در هنگام استفاده از کاتالیزور تهیه شده در PH=9 دارای حداکثر مقدار 7/10و 8/81 % بود. کاتالیزور در PH=9 دارای حداقل اندازه ذرات مس بود که باعث برهمکنش کارآمد بین Cu و ZnO می شود. همه کاتالیزورها، به جز کاتالیزور تهیه شده در PH=6 ، گزینش پذیری متانول را بیش از 80 % نشان می دهند. گزینش پذیری کم در PH=6 به دلیل وجود گونه های Cu+ است. مشخص شد اندازه ذرات مس در طول هیدروژنه شدن CO2 نقش مهمی ایفا میکند و افزایش اندازه ذرات مس، باعث کاهش فعالیت هیدروژناسیون میگردد.
هوانگ و همکاران [21] از یک صفحه ZnO برای تهیه کاتالیزور صفحه Cu/ZnO استفاده کرد و عملکرد آن را در طول هیدروژنه کردن CO2 با استفاده از گازهای کاهنده مختلف ((5 vol% Co–Ar, 2.5 vol% H2/2.5 vol% Co–Ar, and 5 vol% H2 – Ar) در دمای ◦C300 به مدت 6 ساعت ارزیابی کرد. هدف اصلی این مطالعه بررسی اثر همافزایی نانوذرات مس و روی بر فعالیت سنتز متانول بود. واکنش در دمای 220-300 درجه سانتیگراد و فشار 3 مگاپاسکال رخ داد و عملکرد کاتالیزوری کاتالیست از نظر تبدیل و گزینش پذیری در شرایط خاص با تغییر غلظت گاز کاهنده ارزیابی شد. 5 درصد حجمی H2 بیشترین عملکرد و 5 درصد حجمی Co کمترین عملکرد را در همان دما نشان داد. به طور مشابه، گزینش پذیری متانول با استفاده از 5 درصد حجمی H2 و 5 درصد حجمی CO کمترین گزینش پذیری را با همان تبدیل داشتند. استفاده از 5 درصد حجمی H2 افزایش دو برابری در تبدیل CO2 و بازده متانول را در مقایسه با 5 درصد حجمی CO2 نشان داد. کاتالیزور با 5 درصد حجمی H2 دارای کوچکترین اندازه ذرات است. با این حال، نه تنها اندازه ذرات، که شکل ذرات نیز مهم است. کاتالیزور با عملکرد بالا دارای شکل کروی است؛ در حالیکه کاتالیزورهای با شکل نامنظم، عملکرد پایینتری دارند.
3-4-بررسی سینتیکی
احمد و همکاران [22] سینتیک واکنش سنتز متانول را با استفاده از کاتالیزور Ga3Ni5/SiO2 بررسی کردند. دو مدل سینتیک بر اساس معادله لانگمویر-هینسلوود-هوگن-واتسون طراحی شد. آزمایشات عملکرد کاتالیزور در دمای 150 تا 250 درجه سانتیگراد انجام شد و نسبت مولی H2/CO2 در گاز خوراک در محدوده 3 تا 9 تحت فشار اتمسفر بود. داده ها پس از اجرای راکتور به مدت 5-7 ساعت اندازه گیری شد. علاوه بر این، بلوک RGIBBS و راکتور RPLUG در ASPEN PLUS برای مطالعه محدودیتهای ترمودینامیکی و جنبشی هیدروژناسیون CO2 استفاده شد. با استفاده از راکتور RGIBBS در ASPEN PLUS، تبدیل تعادل CO2 به متانول را می توان با به حداقل رساندن انرژی گیبس محاسبه کرد. راکتور RGIBBS از اطلاعات آنتالپی و آنتروپی-گونه برای محاسبه وضعیت تعادل نهایی سیستم چند گونه در دما و فشار معین استفاده میکند. بنابراین، کسر مولی تعادل محاسبهشده از مدل RGIBBS میتواند به عنوان پایه و نقطه شروع مدلسازی راکتور قبل از اجرای سینتیک واکنش واقعی در مدل راکتور دقیقتر تنظیم شود. با استفاده از راکتور RPLUG، تبدیل جنبشی را می توان از مدل جنبشی محاسبه کرد. راکتور RPLUG برای محاسبه تعادل جرم و انرژی برای راکتور جریان پلاگین ایدهآل با پارامترهای جنبشی واکنش طراحی شده است. این ماژول برای شبیهسازی عملکرد جنبشی راکتور (یعنی تبدیل، انتخابپذیری و بازده) بر اساس پارامترهای جنبشی دقیق بهدستآمده از آزمایشها مناسب است. تبدیل CO2 با افزایش دما افزایش یافت و به دلیل محدودیت ترمودینامیکی در 240 درجه سانتیگراد بالاترین مقدار بود. هنگامی که دما افزایش یافت، تبدیل CO2 و گزینش CO2 افزایش یافت، در حالی که انتخاب پذیری متانول روندی نزولی را نشان داد. افزایش نسبت مولی H2/CO2 در خوراک، تبدیل CO2 و گزینشپذیری متانول را افزایش میدهد زیرا H2 اضافی واکنش رو به جلو را ترویج می کند. آنها مکانیسم واکنش و سه مسیر برای تشکیل متانول، یعنی واکنشهای کربوکسیل، RWGS و فرمت را پیشنهاد کردند. در این میان مسیر فرمت با کمترین میزان سد انرژی در نظر گرفته شد. بر اساس این مکانیسم، آنها دو مدل لانگمویر-هینشلوود را با در نظر گرفتن دو موقعیت پیشنهاد کردند.
4-4-بررسی اثر پایه کاتالیست
فوجوتانی [23] اثر ZnO و سایر تکیه گاه های اکسید فلزی را بر فعالیت سنتز متانول مطالعه کرد. آزمایشات آنها نشان داد که ZnO/SiO2 یک اثر هم افزایی با Cu/SiO2 برای تشکیل متانول نشان میدهد. هنگامی که هیچ مقداری از ZnO در کاتالیزور وجود نداشت، فعالیت مشاهده شده در واکنش با افزایش دما تغییری نکرد، در حالی که کاتالیزور با ZnO افزایش قابل توجهی را نشان داد. اثر هم افزایی بزرگتری هنگام استفاده از مقدار بیشتری از ZnO در محدوده دمایی از 300 تا 450 درجه سانتیگراد مشاهده شد. با این حال، فرکانس گردش (TOF) برای سنتز متانول در حداکثر حالت خود حاوی 19/0 از فلز روی بود که با افزایش آن از 2/0، شروع به کاهشی شدن کرد به طوری که وقتی مقدار آن به بیش از 5/0 رسید، هیچ فعالیتی برای سنتز متانول مشاهده نشد. انرژی فعال سازی سنتز متانول 7/83کیلوژول بر مول در 19/0 روی بود. TOF برای CO شروع به کاهش کرد، این کاهش به خصوص در مقدار 15/0-2/0 از فلز روی شروع و در 5/0 صفر شد. سایر اکسیدهای فلزی مانند Al2O3، Ga2O2، ZrO2 و Cr2O3 نیز اثرات هم افزایی با کاتالیزور Cu-ZnO نشان دادند. مشخص شد که Al و Zr باعث افزایش سطح مس و Ga و کروم فعالیت ویژه مس را افزایش میدهد. این کاتالیزورهای چند جزئی فعالیت و پایداری حرارتی بهتری نسبت به کاتالیزورهای دوتایی یا سه تایی نشان دادند. هنگامی که مقدار کمی سیلیس وجود داشت، کاتالیزور پایداری طولانی مدت بهبود یافته ای را نشان داد. این رخداد به این دلیل است که سیلیس، کریستالیزاسیون فلزات را در کاتالیست سرکوب میکند. با اینحال، سیلیس بیش از حد فعالیت کاتالیزوری را کاهش داد و مقدار بهینه سیلیس در محدوده 5/0-9/0 % وزنی، بهترین اثر نشان داد.
چانگ و همکاران [24] مزایای استفاده از تکیه گاه های فلزی برای کاتالیزور را در جهت افزایش جذب CO2، کاهش اندازه کریستال مس و کاهش دمای تفکیک H2 مورد مطالعه قرار دادند. آنها مجموعه ای از کاتالیزورهای جدید مبتنی بر مس را تهیه کردند که با تیتانیوم و سریم دوپ شده بودند. سه نوع کاتالیزور پشتیبانی شده روی CeO2 [(CuCeOx)، TiO2 (CuTiOx)، و CeO2-TiO2 (CuCeTiOx)] با استفاده از روش رسوب همزمان و سل-ژل تهیه شد. آزمایشهای ارزیابی با استفاده از 2/1 گرم کاتالیزور در راکتور بستر ثابت در دمای 235 درجه سانتیگراد، فشار 3 مگاپاسکال و GHSV 2000 میلیلیتر بر گرم کاتالیست در ساعت انجام شد. در طی آزمایشات جنبشی، دما از 190 به 230 درجه سانتیگراد افزایش یافت. کاتالیزور تهیه شده با استفاده از اکسید سه تایی (CuCeTiOx) عملکرد بهتری نسبت به آنهایی که با اکسیدهای دوتایی (CuCeOx و CuTiOx) تهیه شده بود نشان داد. کاتالیزور CeO2–TiO2 (CuCeTiOx) دارای جای خالی اکسیژن بیشتر و سطح بزرگتر است که برای جذب CO2 مهم است. این تبدیل بیش از 7 برابر CO2 را نشان داده و بازده متانول آن نیز بالاتر از سایر کاتالیزورهای مورد مطالعه بود. ترکیب Ce و Ti در کاتالیزور مهم بود زیرا Ce و Ti باعث کاهش مساحت سطح می شود. نسبت Ce/Ti بهینه 1:1 بود. هنگام مقایسه روشهای سل-ژل و رسوب همزمان، روش سل-ژل منجر به انتخاب پذیری بالاتر متانول، اما تبدیل CO2 کمتری میشود. انرژی فعال سازی برای سنتز متانول تقریبا ~9.1 کیلو کالری در مول بود که بسیار کمتر از مس (25 کیلو کالری در مول) یا CuZnO (16 کیلو کالری در مول) بود.
کار و همکاران [25] اثر ساختار مولکولی کاتالیزور و آمین را بر بازده متانول مورد مطالعه قرار داد. آنها Ru-Macho-BH و [RuPNPR (R = Ph, i-Pr, Cy, t-Bu)] را به عنوان کاتالیزور برای بهبود بازده متانول تهیه کردند. واکنش هیدروژناسیون در فشار 75 بار و دمای 145 درجه سانتیگراد با استفاده از نسبت مولی CO2/H2 1:3 طی 40 ساعت رخ داد. کاتالیزور Ru-Macho-BH بالاترین انتخاب پذیری متانول را در بین کاتالیزورهای مورد مطالعه نشان داد. کاتالیزورهای RuPNPR نرخ تولید فرمامید و فرمات بالایی را نشان دادند، اما هیچ بازده متانولی برای هیدروژناسیون CO2 با پنتااتیلن هگزامین نداشتند. با این حال، نتایج تجربی دیگر نشان می دهد که حضور PNPR به جز زمانی که R = t-Bu، برای بازده متانول مناسب و برای هیدروژنه شدن فرمامید ضروری است. حضور آمین نیز برای واکنش هیدروژناسیون مهم بود. این به انحلال CO2 در حلال کمک می کند و واسطه های فرمت از کاتالیزور Ru جدا می شوند. بدون آمین، هیچ هیدروژناسیون CO2 رخ نداده است. نوع آمین مورد استفاده تأثیر جزئی بر کاهش CO2 برای تشکیل متانول دارد. 1،2- دی آمین هایی که جایگزین های اولیه آنهاست یا گروه های آلکیل ثانویه بهترین تولید متانول را دارند، در حالی که گروه های آلکیل سوم و هیدروکسیل، تولید متانول را کاهش می دهند. همچنین باید تاکید کرد که عملکرد کاتالیزور حتی پس از 10 روز واکنش مداوم فعال باقی مانده است و نشان می دهد که عملکرد طولانی مدت را می توان با استفاده از کاتالیزور Ru-Macho-BH به دست آورد. این نشان می دهد که مقادیر ثابت متانول را می توان با استفاده از کاتالیزور تازه در مرحله اولیه عملیات و با جایگزینی کاتالیزور استفاده شده بر اساس اندازه گیری توزیع محصول، به طور پایدار تولید کرد.
محل فعال برای هیدروژناسیون CO2 باید به راحتی قادر به جذب CO2 و تفکیک H2 باشد. اینها را می توان با استفاده از یک خوشه Pd کوچک متوجه شد. یک مطالعه قبلی که عملکرد خوشههای Pd کوچک را بررسی میکرد، نشان داد که خوشههای بسیار کوچک واکنش هیدروژناسیون را بهبود نمیبخشند. برای روشن شدن این پدیده، ساپوترو و همکاران. [26] برهمکنش بین Pd و CO2 را مطالعه کردند. علاوه بر این، آنها مکانیسم واکنش و سینتیک واکنش هیدروژناسیون CO2 را مطالعه کردند. آنها جذب CO2 و انرژی هیدروژناسیون سه اندازه مختلف از خوشههای Pd را تعیین کردند که با استفاده از TOF با استفاده از مدلسازی میکرو جنبشی محاسبه شدند. به طور کلی، قدرت جذب CO2 و Pd با بزرگتر شدن خوشه ضعیف تر می شود. در نتیجه، نانوالیاف تعامل بین CO2 و Pd را تسهیل میکنند. این اثر هم افزایی با کاهش اندازه خوشه Pd افزایش می یابد. 2 نوع واکنش هیدروژناسیون CO2 وجود دارد که با محصول مرحله اول هیدروژناسیون متمایز می شوند: 1) واکنش فرمات، از فرمات (HCOO) و 2) هیدروژناسیون RWGS + CO، شروع از متیل (HOCO). مشاهده شد که خوشه Pd انرژی فعال سازی کمتری در تشکیل HCOO نسبت به تشکیل HOCO دارد. در نتیجه این مشاهدات، خوشههای Pd میتوانند انرژی فعالسازی را برای تشکیل HCOO بهبود بخشند، ولی HOCO را نه. علاوه بر این، با افزایش اندازه خوشه Pd، انرژی فعالسازی واکنش هیدروژناسیون از متوکسی به متانول (H3CO* + H* → H3 COH)، که در هر دو واکنش رخ میدهد افزایش می دهد. این به این دلیل است که افزایش تعداد اتمهای Pd، اوربیتالهای d را محلیسازی کرده و آنها را تثبیت میکند. بنابراین، کنترل اندازه خوشه Pd برای تسهیل واکنش هیدروژناسیون CO2 مهم است.
وانگ و همکاران [27] کاتالیزورهای Cu/CeO2 و Cu/ZrO2 را پیشنهاد کردند که برهمکنش قوی بین فلز و پشتیبانی اکسید برای سنتز متانول را دارند. کاتالیزورها از طریق روش همرسوبی اگزالات تهیه شدند. متانول در دمای 200 درجه سانتیگراد و فشار 3 مگاپاسکال در طی 2 ساعت سنتز شد. نسبت مولی H2/CO2 3:1 بود. عملکرد کاتالیزورها بین 200 تا 300 درجه سانتیگراد مورد بررسی قرار گرفت. نشان داده شد که هر دو پشتیبانی Ce و Zr به طور قابل توجهی عملکرد کاتالیزوری را افزایش می دهند. پشتیبانی CeO2 تبدیل و گزینش پذیری بهتری را نسبت به ZrO2 در محدوده دمایی مورد مطالعه نشان می دهد. کاتالیزور Cu/ZrO2 بالاترین تبدیل CO2 را در مقایسه با سایر کاتالیزورهای مورد مطالعه نشان می دهد. با این حال، انتخاب پذیری متانول به شدت با افزایش دما کاهش یافت. Cu/CeO2 دارای بالاترین گزینش پذیری متانول در تمام دماهای مورد مطالعه بود و بیشترین گزینش پذیری خود را تا دمای 280 درجه سانتیگراد حفظ کرد. با مقایسه طیف های رامان، مشخص شد که در مقایسه با Cu/ZrO2، جای خالی اکسیژن بیشتری در Cu/CeO2 تشکیل شده است. جای خالی اکسیژن بیشتر، گونه های کربنات بیشتری را روی Cu/CeO2 تشکیل می دهد و در نتیجه، Cu/CeO2 فرمات بیشتری (HCOO) و متوکسی (CH3O) که واسطه های کلیدی برای تولید متانول هستند، تولید می کند. این دلیلی است که Cu/CeO2 گزینش پذیری بالاتری نسبت به Cu/ZrO2 در تمام دماهای مورد مطالعه نشان می دهد.
چوی و همکاران [28] یک کاتالیزور مس را با CeO2 دوپ کرد تا به گزینش پذیری بالایی برای متانول با هیدروژناسیون CO2 دست یابد. Pd به کاتالیزور Cu/CeO2 اضافه شد تا فعالیت به سمت تشکیل متانول را بهبود بخشد. کاتالیزورهای حاوی غلظتهای مختلف مس با استفاده از اشباع پالادیم و مس روی CeO2 با استفاده از روش رسوبگذاری تهیه شدند. فعالیت کاتالیزوری در شرایط واکنش 190-270◦C و فشار 3 مگاپاسکال با استفاده از نسبت 3:1 H2/CO2 مورد بررسی قرار گرفت. شرایط دمای بالا تبدیل CO2 را افزایش داد، اما انتخاب متانول را کاهش داد. بنابراین، با توجه به تبدیل و انتخاب، گرم کردن واکنش در دمای 250 درجه سانتیگراد بهترین بهره وری متانول را به همراه داشت. غلظت کاتالیزور نیز بر عملکرد کاتالیست تأثیر می گذارد. نرخ تولید متانول با افزایش غلظت مس افزایش یافت، اما وقتی مقدار آن به بیش از 10 درصد وزنی رسید، نرخ تولید کاهش یافت. آنها دلیل این اتفاق را در تجمع CeO2 اضافی می دانند. دوپینگ مقدار مناسبی از Pd نیز بر عملکرد کاتالیزور Cu/CeO2 تأثیر گذاشت. غلظت مناسب Pd با افزایش پراکندگی مس، غلظت مس را در سطح کاتالیزور افزایش می دهد. از نظر الکتروشیمیایی، ذرات Pd با اهدای الکترون، مس را تثبیت میکنند تا انتقال الکترون افزایش یابد. همچنین باعث کاهش Ce4+ به Ce3+ میشود و جای خالی اکسیژن بیشتری ایجاد میکند. مشخص شد که 1 درصد وزنی Pd مقدار بهینه پالادیم بود و در نتیجه، کاتالیزور 1Pd-10Cu/CeO2 بالاترین تبدیل CO2 را نشان داد.
چو و همکاران [29] بررسی کردند که آیا منگنز ارزان می تواند برای فعال کردن هیدروژناسیون CO2 برای تشکیل متانول استفاده شود یا خیر و برای اولین بار، راهی برای تولید متانول با استفاده از کاتالیزور آمین و منگنز پیشنهاد کردند. واکنش تولید متانول در این حالت، شامل دو مرحله است: 1) فرمیلاسیون CO2 با آمین با استفاده از مورفولین و کاتالیزور منگنز، و 2) هیدروژنه کردن ماده واسطه فرمیله برای تشکیل متانول.
آنها دو کمپلکس مختلف منگنز [C-1 (MnBrPNP-Pr) و C2 (MnBrPNP-Cy)] آماده کردند. در اولین واکنش، مشخص شد که کاتالیزور C-2 (MnBrPNP-Cy) کمتر از C-1 (MnBrPNP-Cy) موثر است. کاتالیزور C-1 (MnBrPNP-Cy) 4-فورمیل مورفولین را در بازدهی 90 درصد در دمای 110 درجه سانتیگراد و 60 بار تولید کرد، در حالی که کاتالیزور C-2 (MnBrPNP-Cy) 4-فرمیل مورفولین را در بازده 66 درصد در شرایط مشابه به دست داد. هنگام استفاده از آمین برای تولید فرمیل مورفولین، بنزیلامین بهترین نتایج واکنش فرمیلاسیون را نشان داد. در واکنش دوم،4-فرمیل مورفولین با استفاده از 2 درصد مولی کاتالیزور و فشار 80 بار H2 بازده 71 درصدی متانول داد. افزایش بار کاتالیست و فشار هیدروژن باعث افزایش بازده متانول شد. کاتالیزور C-1 (MnBrPNP-Cy) نتایج بهتری نسبت به آنچه قبلا گزارش شده بود نشان داد.
در ادامه در جدول (2) موارد دیگری از مطالعات انجام شده در این باره آورده شده است.
جدول (2): کاتالیستهای نوین در سنتز متانول
| کاتالیست | نسبت H2:CO | دما | فشار (MP) | گزینش پذیری متانول | بازده تولید متانول | رفرنس | |
| CuZnO/SiO2 (CuZnO 28.23 wt%) | 1/3 | 220 | 3 | 1/14 | 2/57 | 8 | 30 |
| ZnO-ZrO2 | 1/3 | 320 | 5 | 10 | 83 | 3/8 | 31 |
| CuO-ZnO-ZrO2(1.0 wt)%SiO2 | 1/3 | 240 | 2 | 5 | 70 | 5/3 | 32 |
| Cu2+: Zn2+: Al3+: Zr4+(6/3/5/0.5) | 1/3 | 270 | 5 | 5/24 | 6/57 | 11/14 | 33 |
| Rh/TiO2 | ¼ | 350 | 1/0 | 66 | 100 | 66 | 34 |
| Cu/Zn/Al/Zr(52.5/24.9/17.1/5.5) | 1/3 | 230 | 5 | 3/19 | 5/58 | 3/11 | 35 |
| Cu/Zn/Al/Zr/Fe (52.8/24.6/17.1/5.5/3.33) | 1/3 | 230 | 5 | 18 | 4/68 | 3/12 | 35 |
| In2O3/ZrO2 | 1/4 | 573 | 4 | 5/10 | 53 | 56/5 | 36 |
| . 1.5YIn2O3/ZrO2 | 1/4 | 573 | 4 | 6/7 | 69 | 24/5 | 36 |
| 3La10In/ZrO2 | 1/4 | 573 | 4 | 7/7 | 66 | 08/5 | 36 |
| Cu/Zn/Zr/O(34/13.2/27.9/22.3/2.7) | 1/3 | 240 | 3 | 1/12 | 1/54 | 5/6 | 37 |
| Cu/Zn/Zr/O(29.7/13/29.2/27.6/0.5) | 1/3 | 240 | 3 | 8/4 | 4/73 | 5/3 | 37 |
| Cu/Zn/Al(66/30/11) | 1/3 | 220 | 8/2 | 3/20 | 2/63 | 13 | 38 |
| Cn-Zn/Al foam | 1/3 | 250 | 3 | 6/13 | 5/64 | 7/8 | 39 |
| 10CuZnCr-3.5(wt.%) | 1/3 | 300 | 2 | 1/25 | 1/31 | 8/7 | 40 |
پس از مطالعه و بررسی موارد مختلف مطالعات انجام شده در حوزه کاتالیستهای سنتز متانول، مشخص شد که گونههای مختلفی به عنوان کاتالیستهای نوین برای سنتز متانول مورد آزمایش و ارزیابی قرار گرفته است که بیش تر آنها بازده و گزینشپذیری بسیار بالاتری در مقایسه با گونهی صنعتی مورد استفاده دارند.
با بررسی عوامل گوناگون و ضمن در نظر گرفتن مجموعه ای از موارد اصلی و موثر در پایداری کاتالیست و بهبود عملکرد آن، مانند بازده کاتالیست، گزینشپذیری، دما و فشار عملیاتی و نسبت خوراک، نتیجه این گردآوری در جدول شماره (3) خلاصه میگردد. در نهایت تعدادی از بهترین کاتالیستها به منظور استفاده در صنعت برای تولید متانول پیشنهاد شده است.
جدول (3): کاتالیستهای پیشنهادی پژوهش
| کاتالیست | نسبت H2:CO | دما | فشار (MP) | گزینش پذیری متانول | بازده تولید متانول | |
| Rh/TiO2 | ¼ | 350 | 1/0 | 66 | 100 | 66 |
| PbZn/CeO2 | 1/3 | 220 | 2 | 14 | 95 | 3/13 |
| CeO2-TiO2 (CuCeTiOx ) | 1/3 | 250 | 4 | 1/13 | 90 | 79/11 |
| Cu/ZnO/Al2O3/ZrO2 | 1/3 | 190 | 5 | 1/13 | 8/81 | 7/10 |
| Cu/ZnO/Al2O3 [Ni-Ga] | 1/3 | 80 | 1 | 5/14 | 70 | 15/10 |
| Pd/In2O3 | 1/3 | 300 | 3 | 2/14 | 70 | 94/9 |
| Cu/Zn/Ce | 1/3 | 200 | 5/1 | 20 | 65 | 13 |
| Cu/ZnO2/CNF | 1/3 | 180 | 30 | 78/9 | 92 | 9 |
| Cu/Zn/Al | 1/3 | 230 | 5 | 3/19 | 5/58 | 29/11 |
5- نتیجه گیری
پس از مطالعه و بررسی پژوهش های مختلف در زمینه سنتز کاتالیستهای نوین به منظور تولید متانول نتایج مهم زیر حاصل شد:
دمای واکنش بر درصد تبدیل CO2 و گزینشپذیری متانول تاثیر زیادی دارد: در این باره پژوهش های مختلفی انجام گرفته و درستی گزاره بالا را تایید میکند. در یک بررسی، لی و همکاران تاثیر دما را به وضوح بر درصد تبدیل کربن دی اکسید و گزینش پذیری متانول مشاهده کردند؛ چرا که درصد تبدیل CO2 و گزیشپذیر متانول در دمای 200 درجه سانتی گراد برای کاتالیست Cu/AlCeO به ترتیب برابر با 9/2 % و 85 % بود در حالی که با افزایش دما به 280 درجه سانتی گراد این مقادیر به ترتیب به 7/23 % و 22% تغییر پیدا کرد. این مطالعه تاثیر دما را نشان می دهد و بیانگر این است که درصد تبدیل کربن دی اکسید با دما رابطه مستقیم داشته و با افزایش دما افزایش می یابد ولی گزینش پذیری تاثیر عکس با افزایش دما دارد و هرگاه دما افزایش می یابد، گزینش پذیر متانول کاهش می یابد چرا که با افزایش دما، محصولات جانبی بیشتری تولید می شود. در نتیجه دستیابی به دمای بهینه بسیار مهم و ازجمله اولیت های پژوهش است تا به انتخاب دمای بهینه، هم درصد تبدیل کربن دی اکسید بالا و هم مقدار تولید محصولات جانبی کم باشد و از طرفی در گزینش پذیری کاتالیست برای متانول، کاهش کمتری رخ دهد.
پارامتر دوم تاثیرگذار بر افزایش تولید متانول، تاثیر pH سنتز کاتالیست بود که در این پژوهش به آن اشاره شد. شیائو و همکاران در مطالعات خود تاثیر pH بر کارایی کاتالیست در تولید متانول را اثبات کردند. آنها برای تهیه کاتالیزور برای تولید متانول، مجموعه کاتالیست Cu/ZnO/Al2O3/ZrO2 را انتخاب و سنتز کردند. آن ها در دو مقدار pH برابر با 6 و 9 این سنتز را انجام دادند. نتایج کار آن ها به این شرح بود که وقتی در شرایط یکسان عملیاتی، کاتالیست در pH برابر با 6 سنتز می شود، درصد تبدیل CO2 بسیار کم بوده و گزینش پذیری کاتالیست برای متانول به شدت پایین بود. اما وقتی مقدار pH به 9 افزایش مییابد، درصد تبدیل کربن دی اکسید به 7/10 % و گزینشپذیری متانول به 8/81 % افزایش مییابد که این مطالعه تاثیر زیاد pH را بر درصد تبدیل کربن دیاکسید و گزینشپذیری متانول به صورت کاملا واضحی نشان میدهد. نتایج کار آنها این بود که در pH های بالای 7 میزان تبدیل کربن دیاکسید و گزینشپذیری متانول بسیار بالاتر از pH های کمتر از 7 است.
مورد آخر که سومین پارامتر تاثیرگذار بر سنتز کاتالیست است، ترکیب پایه کاتالیست میباشد. در این مطالعه مشخص شد که بدون پایه کاتالیست، با افزایش دما، مقدار افزایش درصد تبدیل کربن دیاکسید بسیار کم و مقدار کاهش گزینشپذیری متانول بسیار زیاد است. حال آن که در حضور پایه کاتالیست خصوصا پایههای روی اکسید، زیرکونیوم اکسید و سریوم اکسید، درصد تبدیل کربن دیاکسید با افزایش دما، به شدت افزایش یافته و گزینشپذیری متانول نیز بهبود مییابد. این نتیجه را فوجاتانی در مطالعات خود که از پایه ZnO برای سنتز کاتالیست استفاده کرده بود به اثبات رساند.
بنابر آنچه در این مطالعه مورد بررسی قرار گرفت، اهم نتایج به صورت زیر بیان میشود:
- افزایش دما، منجر به افزایش درصد تبدیل کربن دیاکسید میگردد.
- افزایش دما باعث افزایش میزان تولید محصولات جانبی در واکنش تولید متانول میشود.
- افزایش دما باعث کاهش گزینشپذیری متانول و افزایش گزینشپذیری CO میشود.
- با افزایش pH به بالاتر از مقدار خنثی، باعث افزایش کارایی کاتالیست در تبدیل کربن دیاکسید و گزینشپذیری متانول میشود.
- استفاده از پایه برای کاتالیست، باعث عملکرد بهینه کاتالیست در تولید متانول میشود؛ چرا که در حضور پایه کاتالیست، با تغییر جزئی در دما، درصد تبدیل کربن دیاکسید و تولید متانول افزایش چشم گیری دارد.
در انتها براساس نتایج این پژوهش،کاتالیستهای مناسبی که با استفاده از آنها در صنعت، میتوان مقدار تولید متانول را به میزان قابل توجهی ارتقا داد، به شرح ذیل معرفی میگردد:
- Rh/TiO2
- PbZn/CeO2
- CeO2-TiO2 (CuCeTiOx): به دلیل سه ظرفیتی بودن جایگاه اکسیژن، درصد تبدیل کربن دیاکسید افزایش چشمگیری مییابد.
پیشنهادها:
- توسعه و سنتز کاتالیزورهای بالقوه برای بهبود عملکرد، از نظر پایداری طولانی مدت، دوام در شرایط واکنش سخت، و بازده بالا نسبت به محصولات هیدروژنه.
- مطالعه عملکرد کاتالیزورهای بالقوه تحت شرایط مختلف گاز خوراک CO2/H2، ظرفیتهای کاری، و عملیات چند- چرخهای.
- مقایسه چندین کاتالیزور امیدوارکننده، بر اساس ارزیابی فنی اقتصادی فرآیند هیدروژناسیون CO2 از جمله یکپارچه سازی حرارتی و طرح احیای کاتالیزور تحت منابع مختلف هیدروژن.
6- منابع
[1] G. A. Olah, A. Goeppert, G. K. Surya Prakash, , Beyond Oil and Gas: The Methanol Economy, Wiley-VCH, Weinheim, Germany, (2006).
[2] M. Kurtz, H. Wilmer, T. Genger, O. Hinrichsen, M. Muhler, Deactivation of Supported Copper Catalysts for Methanol Synthesis, Catal. Lett., 86 (2003) 77-80.
[3] Melanie Kurtz, Natalia Bauer, Christoph Büscher, Hagen Wilmer, Olaf Hinrichsen, Ralf Becker, Stefan Rabe, Klaus Merz, Matthias Driess, New Synthetic Routes to More Active Cu/ZnO Catalysts Used for Methanol Synthesis, Catal. Lett. , 92 (2004) 49-52.
[4] P. B. Rasmussen, P. M. Holmblad, T. Askgaard, C. V. Ovesen, P. Stoltze, J. K. Nørskov, I. Chorkendorff, Methanol synthesis on Cu(100) from a binary gas mixture of CO2 and H2, Catal. Lett., 26 (1994) 373-381.
[5] J. Szanyi, D. W. Goodman, Methanol synthesis on a Cu(100) catalyst, Catal. Lett., 10 (1991) 383.
[6] J. Yoshihara, C.T. Campbell, Methanol Synthesis and Reverse Water–Gas Shift Kinetics over Cu(110) Model Catalysts: Structural Sensitivity, J. Catal., 161 (1996) 776-782.
[7] C. Baltes,, S. Vukojevic, F. Schuth, Correlations between synthesis, precursor and catalyst structure and activity of a large set of CuO/ZnO/Al2O3 catalysts for methanol synthesis, J. Catal., 258 (2008) 334-344.
[8] Shin-ichiro Fujita, Yoshinori Kanamori, Agues Muhamad Satriyo, Nobutsune Takezaw, Nobutsune Takezawa, Methanol synthesis from CO2 over Cu/ZnO prepared from various coprecipitated precursors, Catal. Today, 45 (1998) 241-244.
[9] Arpad F. Somogyvari, Denise Rechel, David Vashinav and Patricio S.Herrera, Bench Scale and Plant Experience with Commercial Methanol Synthesis, Natural Gas Conversion Natural gas conversion III : proceedings of the Third Natural Gas Conversion Symposium, Sydney, July 4-9, 1993, published (1994) 355-360.
[10] K.M. Kuipers, Kinetic studies of High Praessre methanol synthesis, Chem. Eng. Prog. Symp. Ser., (2015) 1.
[11] E.R.A. Matulewicz, Ph. D Thesis University of Amesterdam, (1984).
[12] R. M. Agny, G. C. Takoudis, Synthesis of Methanol from Carbon Monoxide and Hydrogen over Copper Zinc Oxide Alumina Catalyst, Ind. Eng. Prod. Res. Dev, 24 (1985) 50-61.
[13] R. G. Herman, K. Klier, G. W. Simmons, B. P. Finn, T. P. Kobylinski, Catalytic synthesis of methanol from CO/H2: I. Phase composition, electronic properties, and activities of the Cu/ZnO/M2O3 catalysts, J. Catal., 56 (1979) 407-429.
[14] B. Beguin, B. Denise, R. P. A. Sneeden, React. Kinet. Catal. Lett., 14 (1980) 9-20.
[15] K. Chang, T. Wang, J.G. Chen, “Hydrogenation of CO2 to methanol over CuCeTiOx catalysts,”, Appl. Catal. B Environ. 206 (2017) 704–711, https://doi. org/10.1016/j.apcatb.2017.01.076.
[16] S. Li, L. Guo, T. Ishihara, “Hydrogenation of CO2 to methanol over Cu/AlCeO catalyst,”, Catal. Today 339 (January) (2019) 352–361, https://doi.org/10.1016/ j.cattod.2019.01.015, 2020.
[17] V.D.B.C. Dasireddy, B. Likozar, “The role of copper oxidation state in Cu/ZnO/ Al2O3 catalysts in CO2 hydrogenation and methanol productivity,”, Renew. Energy 140 (2019) 452–460, https://doi.org/10.1016/j.renene.2019.03.073.
[18] H.K.D. Nguyen, T.H. Dang, N.L.T. Nguyen, H.T. Nguyen, N.T. Dinh, “Novel Ni-Ga alloy based catalyst for converting CO2 to methanol,”, Can. J. Chem. Eng. 96 (4) (2018) 832–837, https://doi.org/10.1002/cjce.23006.
[19] O.A. Ojelade, S.F. Zaman, “Co2 hydrogenation to methanol over PdZn/CeO2 catalyst,”, C. R. Acad. Bulg. Sci. 72 (6) (2019) 732–739, https://doi.org/10.7546/ CRABS.2019.06.05.
[20] S. Xiao, et al., “Highly efficient Cu-based catalysts via hydrotalcite-like precursors for CO2 hydrogenation to methanol,”, Catal. Today 281 (2017) 327–336, https:// doi.org/10.1016/j.cattod.2016.02.004.
[21] C. Huang, et al., “CO2 hydrogenation to methanol over Cu/ZnO plate model catalyst: Effects of reducing gas induced Cu nanoparticle morphology,”, Chem. Eng. J. 374 (January) (2019) 221–230, https://doi.org/10.1016/j. cej.2019.05.123.
[22] K. Ahmad, S. Upadhyayula, “Kinetics of CO2 hydrogenation to methanol over silica supported intermetallic Ga3Ni5 catalyst in a continuous differential fixed bed reactor,”, Int. J. Hydrogen Energy 45 (1) (2020) 1140–1150, https://doi.org/10.1016/j.ijhydene.2019.10.156.
[23] T. Fujitani, “Enhancement of the catalytic performance and active site clarification of Cu/ZnO based catalysts for methanol synthesis by CO2 hydrogenation,”, J. Japan Pet. Inst. 63 (2) (2020) 43–51, https ://doi.org/ 10.1627/jpi.63.43.
[24] W. Zhang, X.L. Ma, H. Xiao, M. Lei, J. Li, “Mechanistic investigations on thermal hydrogenation of CO2 to methanol by nanostructured CeO2(100): the crystalplane effect on catalytic reactivity,”, J. Phys. Chem. C 123 (18) (2019) 11763–11771, https://doi.org/10.1021/acs.jpcc.9b02120.
[25] S. Kar, et al., “Mechanistic insights into ruthenium-pincer-catalyzed amineassisted homogeneous hydrogenation of CO 2 to methanol,”, J. Am. Chem. Soc. (2019) https://doi.org/10.1021/jacs.8b12763.
[26] A.G. Saputro, et al., “Theoretical study of CO2 hydrogenation to methanol on isolated small Pdx clusters,”, J. Energy Chem. 35 (2019) 79–87, https://doi.org/ 10.1016/j.jechem.2018.11.005.
[27] W. Wang, Z. Qu, L. Song, Q. Fu, “CO2 hydrogenation to methanol over Cu/CeO2 and Cu/ZrO2 catalysts: tuning methanol selectivity via metal-support interaction,”, J. Energy Chem. 40
[28] E.J. Choi, Y.H. Lee, D.W. Lee, D.J. Moon, K.Y. Lee, “Hydrogenation of CO2 to methanol over Pd–Cu/CeO2 catalysts,”, Mol. Catal. 434 (2017) 146–153, https:// doi.org/10.1016/j.mcat.2017.02.005.
[29] W.Y. Chu, Z. Culakova, B.T. Wang, K.I. Goldberg, “Acid-Assisted hydrogenation of CO2 to methanol in a homogeneous catalytic cascade system,”, ACS Catal. 9 (10) (2019) 9317–9326, https://doi.org/10.1021/acscatal.9b02280.
[30] Y. Jiang, et al., “Slurry methanol synthesis from CO2 hydrogenation over microspherical SiO2 support Cu/ZnO catalysts,”, J. CO2 Util. 26 (January) (2018) 642–651, https://doi.org/10.1016/j.jcou.2018.06.023.
[31] J. Wang, et al., “A highly selective and stable ZnO-ZrO2 solid solution catalyst for CO2 hydrogenation to methanol,”, Sci. Adv. 3 (10) (2017) 1–11, https://doi.org/ 10.1126/sciadv.1701290.
[32] T. Phongamwong, et al., “CO2 hydrogenation to methanol over CuO–ZnO–ZrO2–SiO2 catalysts: effects of SiO2 contents,”, Chem. Eng. J. 316 (2017) 692–703, https://doi.org/10.1016/j.cej.2017.02.010.
[33] X. Dong, F. Li, N. Zhao, Y. Tan, J. Wang, F. Xiao, “CO2 hydrogenation to methanol over Cu/Zn/Al/Zr catalysts prepared by liquid reduction,”, Cuihua Xuebao/ Chinese J. Catal. 38 (4) (2017) 717–725, https://doi.org/10.1016/S1872-2067 (17)62793-1.
[34] P. Panagiotopoulou, “Hydrogenation of CO2 over supported noble metal catalysts,”, Appl. Catal. A Gen. 542 (March) (2017) 63–70, https://doi.org/ 10.1016/j.apcata.2017.05.026.
[35] P. Gao, et al., “Fluorinated Cu/Zn/Al/Zr hydrotalcites derived nanocatalysts for CO2 hydrogenation to methanol,”, J. CO2 Util. 16 (2016) 32–41, https://doi.org/ 10.1016/j.jcou.2016.06.001.
[36] C.Y. Chou, R.F. Lobo, “Direct conversion of CO2 into methanol over promoted indium oxide-based catalysts,”, Appl. Catal. A Gen. 583 (July) (2019) 117144, https://doi.org/10.1016/j.apcata.2019.117144.
[37] L. Li, D. Mao, J. Yu, X. Guo, “Highly selective hydrogenation of CO2 to methanol over CuO-ZnO-ZrO2 catalysts prepared by a surfactant-assisted co precipitation method,”, J. Power Sources 279 (2015) 394–404, https://doi.org/10.1016/j. jpowsour.2014.12.142.
[38] S. Ren, et al., “Highly active and selective Cu-ZnO based catalyst for methanol and dimethyl ether synthesis via CO2 hydrogenation,”, Fuel 239 (September) (2018) 1125–1133, https://doi.org/10.1016/j.fuel.2018.11.105.
[39] Z. Liang, P. Gao, Z. Tang, M. Lv, Y. Sun, “Three dimensional porous Cu-Zn/Al foam monolithic catalyst for CO2 hydrogenation to methanol in microreactor,”, J. CO2 Util. 21 (July) (2017) 191–199, https://doi.org/10.1016/j. jcou.2017.05.023.
[40] S. Xiong, Y. Lian, H. Xie, B. Liu, “Hydrogenation of CO2 to methanol over Cu/ ZnCr catalyst,”, Fuel 256 (March) (2019) 115975, https://doi.org/10.1016/j. fuel.2019.115975.
[1] – Calcination
[2] – Site
[3] – Matulewicz
[4] – Agny
[5] – Takoudis
[6] – Herman





گذاشتن کامنت
برای ارسال کامنت باید �ر نظر دهید.